近日,亚新平台(中国)医学院王亚洲教授和生物工程学院尹铁英教授团队在工程化外泌体研究领域取得重要进展。该团队面向中枢神经系统相关疾病(如阿尔茨海默病),提出了一种基于杂交细胞工程化定制多功能外泌体实现精准治疗的新策略。相关研究成果以“Hybridoma-inspired strategy crafts tailored multifunctional exosomes for precision therapy”为题,长文在线发表于国际顶级刊物《美国科学院院刊》(PNAS)。
该成果由亚新平台(中国)研究团队独立完成,亚新平台(中国)2021级博士生董铸峰为论文第一作者,医学院王亚洲教授为论文的通讯作者,生物工程学院尹铁英教授为论文共同第一作者和共同通讯作者。
外泌体(Exosomes)因其纳米级尺寸效应与承继来源细胞生物学功能的特性,在神经退行性疾病、肿瘤和心脑血管疾病等重大疾病的诊疗方面已展现出巨大的潜力。然而,外泌体功能化修饰面临制备效率低、膜蛋白失活、膜结构破坏等局限,特别是对于非可传代培养细胞(如NEs)来源外泌体的规模化制备尚无合适方法,这使得外泌体在临床转化过程中依然面临着严峻挑战。因此,进一步探索外泌体功能化修饰与规模化制备技术是亟待解决的关键问题。
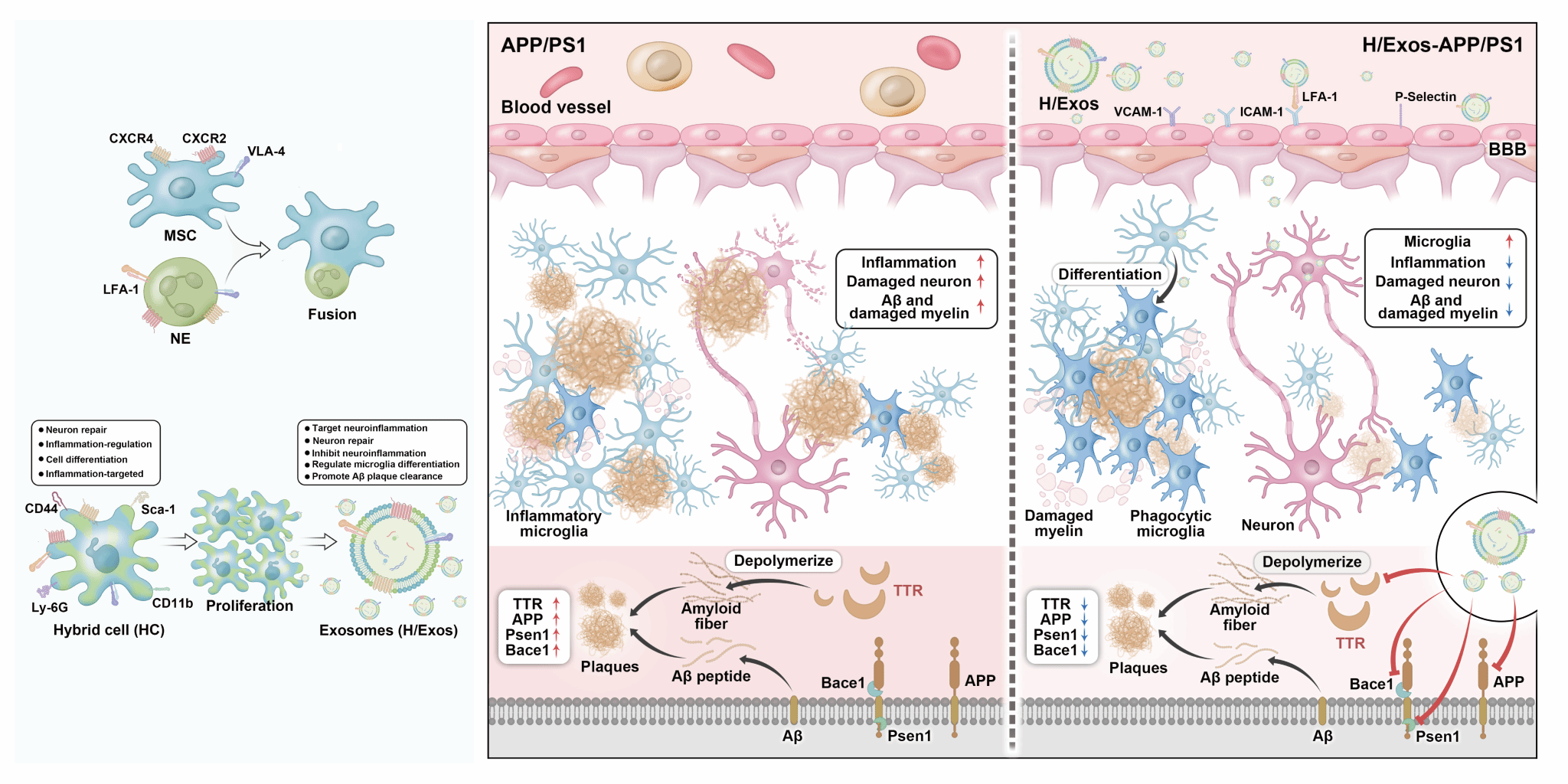
图1. MSCs-NEs杂交细胞制备及其外泌体H/Exos精准治疗阿尔茨海默病的相关机制
针对这一挑战,研究团队通过构建间充质干细胞(MSCs)与中性粒细胞(NEs)杂交细胞(图1),证实了MSCs-NEs杂交细胞(HCs)兼具MSCs与NEs的生物学特性,且其外泌体H/Exos承继了NEs快速炎症响应与MSCs组织修复特性;经多次传代培养后,HCs及其外泌体表型仍能维持稳定。在阿尔茨海默病(Alzheimer's disease,AD)动物模型中,研究团队发现H/Exos能够跨血脑屏障(BBB)精准快速炎症响应,一方面通过调控小胶质细胞表型,显著抑制神经炎症反应并增强Aβ清除能力;另一方面通过修复溶酶体功能、改善线粒体稳态及神经元突触可塑性,最终显著改善AD模型小鼠的认知功能障碍(图2)。
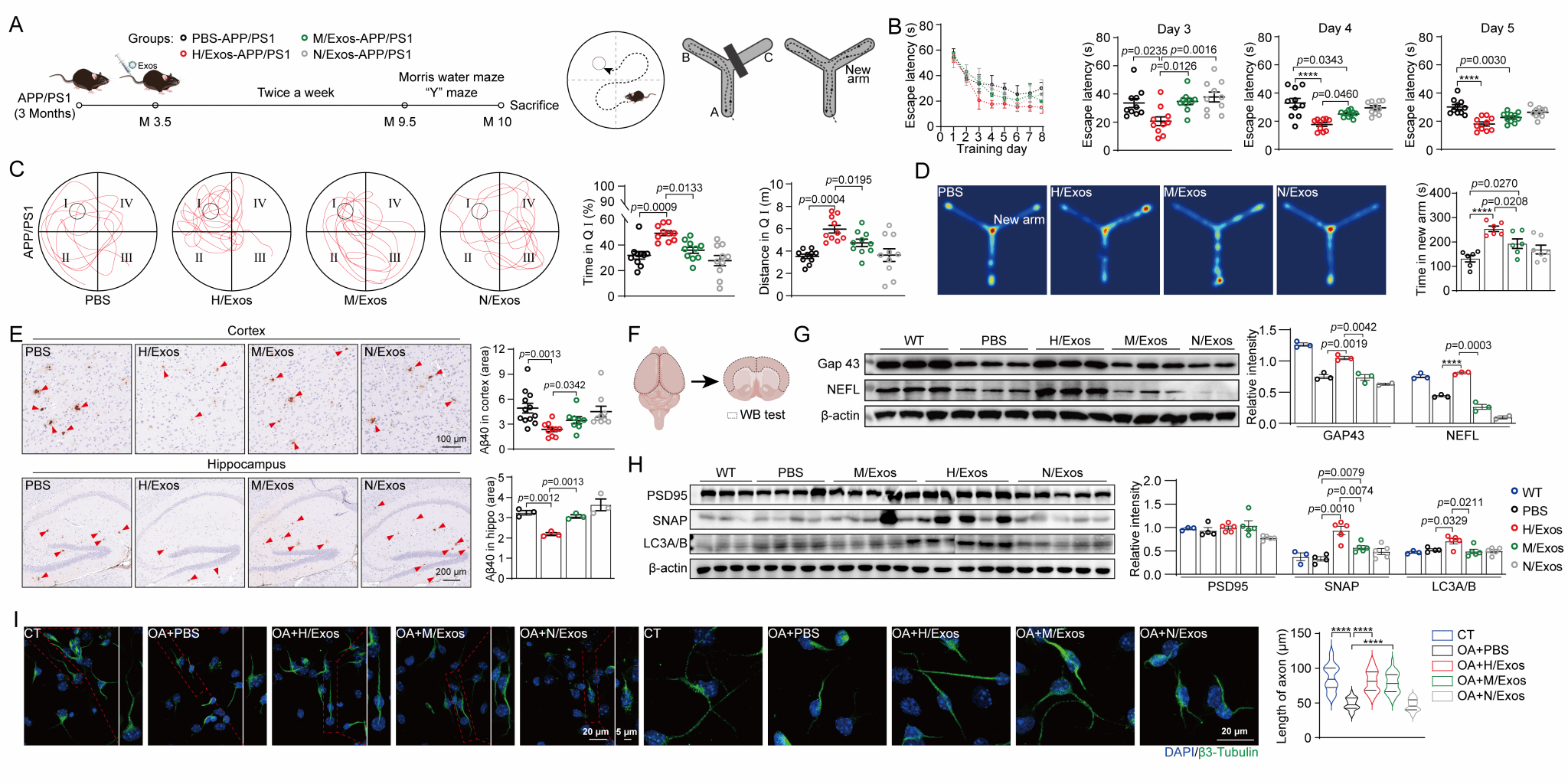
图 2. 杂交细胞外泌体修复神经元损伤改善APP/PS1小鼠认知功能
该创新策略具有巨大的临床转化潜力,基于杂交细胞进行外泌体工程化修饰,不仅为模块化、多功能外泌体的工程定制开辟了新的道路,可实现针对不同疾病类型、不同病患个体的不同杂交细胞组合实现疾病的个性化精准治疗,也为非可传代培养细胞来源外泌体的规模化制备提供了强大的技术平台。
该工作得到了国家自然科学基金、重庆市自然科学基金和中央高校基本科研等项目的资助。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2424547122
来源:医学院